药物临床试验项目结题指引
稿件来源:药物临床试验机构办公室
发布日期:2024-12-25
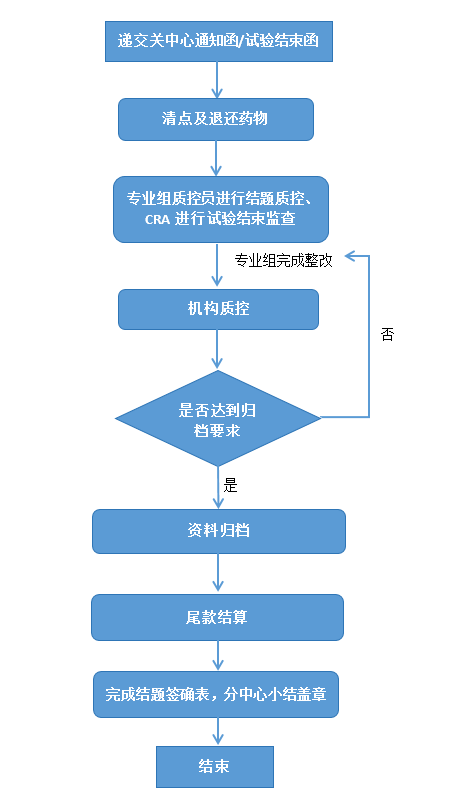
一、申办者/CRO递交关中心函或试验结束函至PI、机构办及伦理委员会。
二、完成结题签确表。
(一)清点剩余试验药物及物资,退返剩余药物及物资至申办者/CRO。
(二)专业组质控员结题质控,CRA完成试验结束监查访视,所有的问题得到整改后方可进行数据锁库。
(三)按照“药物临床试验资料归档登记表”的要求整理及装订相关资料,并送往机构办公室申请结题质控,同时提交项目总结报告及《中山大学附属第八医院(深圳福田)临床试验结题签认表》。
(四)机构质控员进行结题质控,如发现问题,填写质控报告并交予项目负责人,要求其对质控检查中发现的问题进行整改及反馈。
(五)确认所有问题得到解决后,由机构资料管理员清点所有资料,进行归档管理。
(六)项目经费:
1. 尾款结算前应完成所有受试者相关费用的报销,并与PI确认最终的研究者费用,与机构办最后核实管理费等,确定最终尾款。
2. 尾款结算后方可进行结题确认表签字,并开具发票。
(七)分中心小结盖章:
1. 递交分中心小结或总结报告给机构办审核。
2. 完成结题签确表后机构办进行盖章。