我院黄辉教授与多单位合作,发现色氨酸代谢异常导致动脉钙化
在临床中,急性心肌梗死和中风事件的主要原因已被追溯到动脉粥样硬化斑块破裂,其中钙化斑形成是内膜动脉粥样硬化斑核心,针对其研究是目前心血管领域重大科学问题。动脉钙化是以羟基磷灰石晶体异位沉积在血管中为特征,促进动脉的易损性和破裂。动脉钙化在现在被认为是类似于成骨细胞分化的一种主动的成骨分化过程,血管平滑肌细胞(VSMCs)是主要的贡献者。但由于对动脉钙化的发病机制缺乏全面的认识,目前还没有确定有效的干预措施。
IDO1(吲哚胺2,3-双加氧酶1)是色氨酸代谢的关键性酶,犬尿氨酸是主要的初始下游产物,犬尿氨酸与色氨酸的比率反映了IDO1的活性。IDO1功能障碍被证实与动脉粥样硬化的发病机制有关。RUNX2(runt相关转录因子2)是成骨细胞分化和软骨细胞成熟的标志,具有成骨表型的VSMCs可促进动脉粥样硬化钙化和斑块不稳定。然而,目前尚不清楚IDO1缺失介导的色氨酸代谢异常是否会导致 VSMCs成骨重编程和钙化。
代谢和动脉钙化之间的关系一直是黄辉教授团队的重要研究方向,最近我院副院长、心血管疾病专家黄辉教授及美国医学科学院院士、乔治亚州立大学邹明辉教授团队联合在Circulation(IF=30)发表了题为“Indoleamine 2,3-Dioxygenase 1 Deletion–Mediated Kynurenine Insufficiency in Vascular Smooth Muscle Cells Exacerbates Arterial Calcification”的文章,首次揭示了IDO1及其代谢物在抑制动脉钙化中的作用,为治疗其提供了新思路。

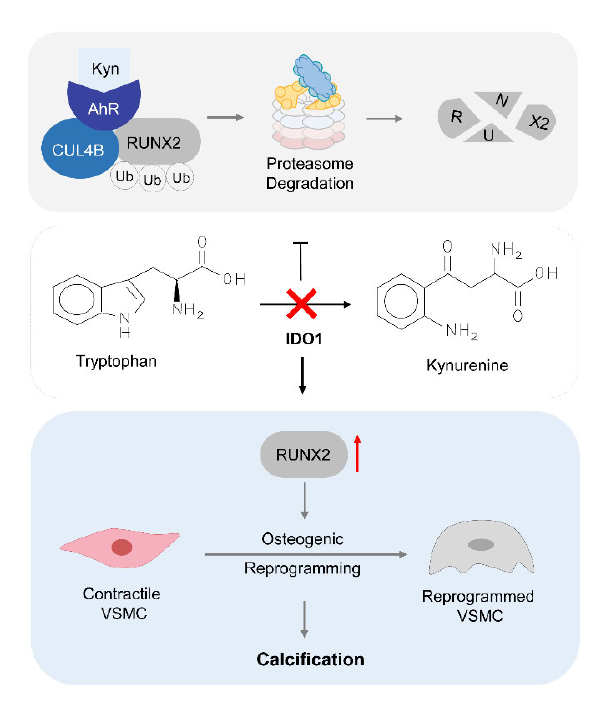
该研究在临床样本中发现,与没有钙化的患者相比,在冠状动脉钙化患者的血清样本中IDO1活性受损,色氨酸分解代谢物(包括犬尿氨酸等)减少。体外实验发现,IDO1的整体缺乏加重体内动脉粥样硬化钙化。进而揭示在VSMCs而非巨噬细胞中的条件性IDO1功能丧失,促进钙化病变的发展和RUNX2的表达增加。相比之下,体内补充犬尿氨酸可显著抑制内膜钙化的进展,并且使RUNX2的表达降低。进一步研究发现IDO1的缺失抑制了RUNX2的蛋白酶体降解,从而增强了VSMCs的成骨重编程。IDO1的下游产物犬尿氨酸作为芳烃受体的内源性配体,控制cullin 4B和芳烃受体之间的相互作用,形成与RUNX2结合的CUL4BAhR E3泛素连接酶复合体,随后促进RUNX2的泛素化-蛋白酶体降解。
总之,该研究发现,犬尿氨酸是一种IDO1介导的色氨酸代谢的主要产物,可通过芳烃受体依赖的非基因组途径促进RUNX2的泛素化,从而导致其蛋白酶体降解。而IDO1缺失导致的犬尿氨酸不足会促进RUNX2介导的VSMCs成骨重编程和体内钙化。
该工作由中山大学附属第八医院联合佐治亚州立大学、中山大学深圳药学院和东华医院共同完成,第一作者欧阳柳为黄辉教授博士生,共同通讯作者黄辉教授多年来一直致力于动脉钙化、血管衰老的研究,注重与不同团队的合作共赢,持续和英国格拉斯哥大学、美国加利福尼亚大学和澳门科技大学及企业等合作,在高血压、心肾对话新媒介、炎性衰老和表观遗传学等方面,探索动脉钙化发生机制和临床转化,取得系列创新性成果,在该领域已经发表相关研究成果,包括Circulation(2022)、J Clin Invest(2021,2022)和Hypertension(2018,2021,2022)等专业期刊。
通讯员--冯敏嘉






