中山大学附属第八医院(深圳福田)临床试验伦理委员会简介及联系方式
一、临床试验伦理委员会主要职责:
1. 起草、修订和审议本伦理委员会的制度、标准操作规程、审查指南等审查具体执行条款,提请机构伦理委员会审议。
2. 负责对医院院本部及社康中心范围内开展的药物、器械、诊断试剂等临床试验项目的伦理审查。
3. 为临床试验申请项目提供伦理审查咨询。
4. 按规定接受上级卫生行政管理部门和/或食品药品监督管理部门督导检查,并向机构伦理委员会报告年度伦理审查工作情况。
二、成员组成:临床试验伦理委员会最近一次调整为2022年8月,设主任委员1名,副主任委员1名,委员7名,总数为9名,其中男性5名,女性4名。
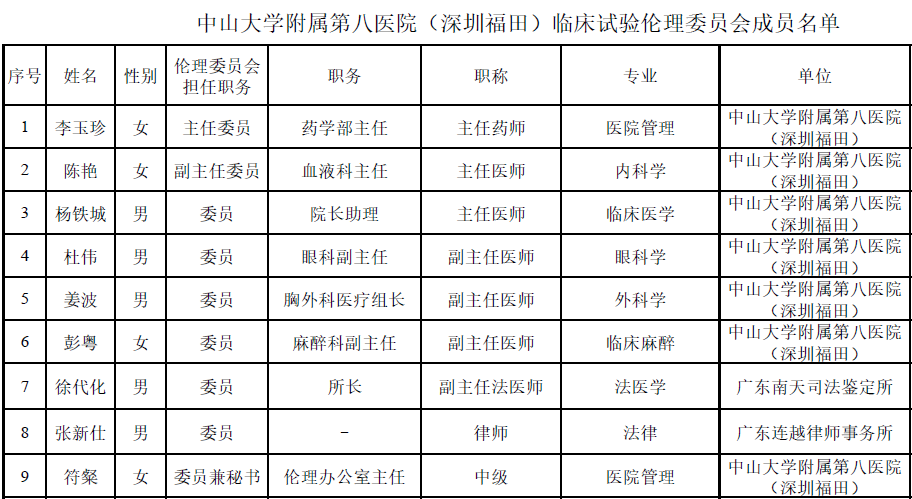
三、临床试验伦理委员会审查收费标准
1.初始审查收费标准:
1.1 符合会议审查要求,评审费6000元/项。
1.2 符合简易审查要求,评审费3000元/项。
1.3 申办方因项目进度需加急进行审查,在征求伦理委员会主任委员同意后,可考虑申请加急,并另缴纳紧急费1500元/项。(具体请询伦理办公室)
2.复审收费标准:
作必要的修正后同意项目及申办方有异议提出复审,可由伦理委员会主任委员决定采用会议审查或简易审查,评审费均为3000 元/项。
3.跟踪审查收费标准:
3.1 非预期严重不良反应事件(SUSAR)审查、年度/定期跟踪审查、暂停/终止研究审查、结题审查不收取费用。
3.2 修正案审查,评审费3000元/项。
3.3 违背方案审查,评审费2000元/季度。
※以上收费标准均已含税。
四、联系方式:
临床试验伦理委员会联系地址:深圳市福田区福华路92号中大八院行政楼406伦理办公室
联系电话:0755-82563178(正常工作日8:00-12:00,14:00-17:00)
电子邮箱:zdbyllb04@163.com(持续更新)
※申办方相关人员联系伦理审查业务时请使用公司后缀的个人邮箱,并在邮件主题开头注明“GCP+公司及项目简称”字样,邮件中至少应说明①申办方名称、②该联系邮箱人员姓名及身份、③项目名称、④项目承办科室及PI姓名。伦理办公室将及时发送相关详细指引。
联系人:符粲






